Hier findest du alles, was du zum Periodensystem der Elemente (PSE) und BOHRschen Atommodell bis zur 10. Klasse wissen musst. Wir beginnen mit Rätseln und digitalen Karteikarten zum Lernen, weiter unten findest du dann ausgearbeitet alle Themen:
Digitale Karteikarten zu Atombau und PSE
Rätsel zum Thema - Teste Dich!
Quiz zum PSE mit Fragen, die in der mündlichen Prüfung schon gestellt wurden.
Und hier gibt's ein Kreuzworträtsel für die wichtigen Begriffe (Onlineversion).
Ordnung in der Vielfalt der Elemente - PSE
Das PSE (= Periodensystem der Elemente) wurde 1869 von Mendelejew entwickelt. Es zeigt alle Elemente in einer Tabelle sortiert nach ihrer Ordnungszahl und ihren Eigenschaften in Hauptgruppen (Spalten) und Perioden (Zeilen).
Hier kannst Du ein gut sortiertes PSE in Farbe herunterladen.
Was das alles zu bedeuten hat, sieht man gut im Zusammenhang mit dem Bau der Atome. Daher werde ich erst einmal darauf eingehen. Beide - Atombau und PSE - gehören sehr eng zusammen.
Atome - Die Bausteine aller Dinge
Was ist denn nun ein Atom und was hat das Ganze mit Chemie zu tun?
Ein Atom ist der kleinste Grundbaustein aller Materie - also all dessen, was Du sehen, fühlen, anfassen, riechen, schmecken kannst, z.B. Nahrung, Steine und Gebirge, Lebewesen, Wolken, Wasser, Luft, Tische, Wände.... einfach von allem.
Ihr Bau bestimmt, welche Eigenschaften Elemente haben, ob und wie sie sich miteinander verbinden und welche Eigenschaften der neue Stoff dann hat.
Früher dachte man, Atome seien nicht weiter zerlegbar - eine Irrvorstellung, wie wir heute wissen. Aber: von dieser Vorstellung stammt der Name "Atom". Er leitet sich aus dem griechischen Wort atomos ab, was "das Unteilbare" bedeutet.
Es gibt exakt so viele Atomsorten wie es Elemente im PSE gibt. Elemente bestehen stets nur aus einer Atomsorte.
Wenn Du die folgenden Links anklickst, siehst Du sehr gute Lehrfilme zur Materie und ihrem Aufbau (1. Video: Teilchenmodell, 2. Video: Atommodell):


Atombau
Rechts ist ein Atom in 2D, links hübsch in 3D dargestellt. Die 2D-Darstellung ist einfacher und wird daher in der Schule oft verwendet. Es ist die Darstellung von Niels Bohr, einem dänischen Physiker. Er hat herausgefunden, dass sich die Elektronen auf Bahnen um den Atomkern herum bewegen. Die Elektronen folgen dabei einer bestimmten Anordnung. Dieses einfache Atommodell heißt nach ihm BOHR'sches Atommodell.
Ein Atom besteht aus sogenannten Elementarteilchen, die auf bestimmte Weise im Atom angeordnet sind.
Die Elementarteilchen sind:
Protonen - positiv geladen (+)
Elektronen - negativ geladen (-)
Neutronen - ungeladen, "neutral"
Ein Atom besteht zunächst aus einem Kern (Nucleus) in der Mitte und einer Hülle drumherum.
Im Kern "wohnen" die Protonen und Neutronen, er ist also positiv geladen. Außerdem macht er den Hauptbestandteil der Atommasse aus.
In der Hülle flitzen die Elektronen festgelegt auf Bahnen herum. Die Atomhülle ist also negativ geladen.
Hier findest Du einen kleinen Lehrfilm dazu, der sehr gut veranschaulicht, wie die Anordnung der Elementarteilchen im Atom ist und wie sich die Atomsorten voneinander unterscheiden.

Die Zahl der positiven Ladungen (Protonen) und der negativen Ladungen (Elektronen) ist im Atom stets gleich. Nach außen hin ist ein Atom also ungeladen, da sich alle positiven und negativen Ladungen ausgleichen.
Diese Erkenntnisse haben wir einem Mann namens Ernest RUTHERFORD zu verdanken, der 1911 dieses Modell aufstellte.
Nur 2 Jahre später (1913) entwickelte Niels BOHR dieses Atommodell weiter, indem er herausfand, dass sich die Elektronen nicht irgendwie in der Hülle bewegen, sondern auf festgelegten Bahnen, auf denen jeweils nur eine bestimmte Anzahl an Elektronen Platz hat; das hat etwas mit Energie und Energieniveaus zu tun, die uns an dieser Stelle aber erst einmal nicht weiter interessieren. Das Bohr'sche Atommodell ist bis heute gültig. Es kann uns erklären, wie chemische Reaktionen zustande kommen. Natürlich hat sich auch das Atommodell weiter entwickelt. Wenn Du die Schule für das Abitur weiter besuchst und Chemie nicht gerade abwählst, lernst Du auch etwas zum sogenannten Orbitalmodell, das heute eher genutzt wird. Für das anfängliche Verständnis, wie sich Atome verhalten und miteinander verbinden, reicht allerdings das Bohr'sche Atommodell völlig aus.
Ich will Dir anhand von einigen Beispielen zeigen, wie man das Bohr'sche Atommodell aufzeichnen kann.
Nimm Dir dazu das PSE zur Hand und sieh Dir zuerst die Legende an. An der Legende siehst Du, welche Zahl wo steht und was sie bedeutet. Ich habe hier ein PSE, in dem die Nebengruppen, die Lanthanoide und Actinoide ausgekreuzt sind. Auf sie treffen alle Gesetzmäßigkeiten des PSE zwar zu, die wir hier lernen, aber sie verhalten sich anders aufgrund weiterer Gesetzmäßigkeiten und deshalb wollen wir sie ausklammern. Bis zur 10. Klasse, ja selbst im Abitur werden ihre Besonderheiten nicht besprochen. Es gibt einige wenige, deren Bedeutung für unseren Alltag hoch ist und die deshalb einzeln noch gelehrt werden. Aber wir werden nicht weiter auf ihren Atombau eingehen.
Uns interessieren also vor allem die Hauptgruppenelemente. Das sind alle, über deren Spalten "Hauptgruppe" steht.
Zu den Hauptgruppen und ihren Namen
Die Hauptgruppen und Nebengruppen sind in den älteren PSE jeweils mit römischen Ziffern von I bis VIII bezeichnet. In den neueren stehen dann Nummern über allen Gruppen - von 1-18. Wir nutzen hier sinnvollerweise ein älteres PSE, da die Nummern 1 bis 8 eine besondere, für die Chemie und das Aufstellen von chemischen Gleichungen wichtige Bedeutung haben.
Wenn Du die römischen Zahlen nicht kennst, schreib dir am besten über dein eigenes PSE die Hauptgruppennummern dazu.
I - Hauptgruppe Nr. 1: Alkalimetalle (mit Ausnahme von Wasserstoff)
II- Hauptgruppe Nr. 2: Erdalkalimetalle
Hauptgruppen 3, 4, 5 und 6 werden nach ihrem obersten Element benannt:
III- Hauptgruppe Nr. 3 (Borgruppe)
IV- Hauptgruppe Nr. 4 (Kohlenstoffgruppe)
V - Hauptgruppe Nr. 5 (Stickstoffgruppe)
VI- Hauptgruppe Nr. 6 (Sauerstoffgruppe)
VII- Hauptgruppe Nr. 7, Halogene
VIII- Hauptgruppe Nr. 8, Edelgase
Es gibt nur 8 Hauptgruppen. Das hat etwas zu bedeuten, wir kommen noch darauf.
Zusammenhang zwischen PSE und Atombau
Die Ordnungszahl zeigt Dir direkt die Anzahl der Protonen. Sie ist im Atom genau gleich mit der Anzahl der Elektronen.
Nehmen wir uns dazu z.B. das Wasserstoff-Atom, das kleinste aller Atome im Universum.
Es hat die Ordnungszahl 1.
Das heißt, es besitzt 1 Proton und 1 Elektron.
Außerdem hat es das Atomgewicht von rund 1. Das Atomgewicht wird im Wesentlichen durch die Protonen und Neutronen im Kern bestimmt. Ein Proton hat ein Gewicht von 1 und ein Neutron auch.
So kann man einfach ausrechnen:
Atommasse (auf ganze Zahl gerundet) - Protonenzahl = Neutronenzahl.
Da Wasserstoff mit dem chemischen Zeichen H das Atomgewicht ca. 1 hat und bereits 1 Proton besitzt, rechnet man: 1 - 1 = 0.
Es hat also kein Neutron.
Und so sieht es aus:

Schauen wir uns ein weiteres Atom an: Magnesium

Magnesium (Mg) hat die Ordnungszahl 12, davon kann man ableiten:
P+ (Protonen) = 12
E (-) (Elektronen) = 12
Sein Atomgewicht ist gerundet 24. Zieht man nun die Protonen von der Atommasse ab, bleiben 12 Neutronen übrig (VORSICHT: Nicht in jedem Atom sind die Protonen und Neutronen gleich, rechne immer Atommasse - Protonenzahl).
N (Neutronen) = 12
Und so sieht es aus:

Hier sind nun einige Bahnen dazugekommen. Die Verteilung der Elektronen ist bei den Hauptgruppen-Elementen festgelegt, wobei die innerste Bahn nahe dem Atomkern die Zahl 1 erhält und alle weiteren Bahnen nach außen fortlaufend nummeriert werden:
1. Bahn (K-Schale genannt): max. 2 Elektronen
2. Bahn (L-Schale): max. 8 Elektronen
3. Bahn (M-Schale): max. 18 Elektronen
4. Bahn (N-Schale): max. 32 Elektronen
5. Bahn (O-Schale): max. 50 Elektronen
6. Bahn (P-Schale): max. 72 Elektronen
7. Bahn (Q-Schale): max. 98 Elektronen.
Ist eine Bahn mit der maximalen Anzahl an Elektronen belegt, befinden sich weitere Elektronen auf der nächsten Bahn, bis auch diese voll ist.
Sehen wir uns das Magnesium-Atom oben nochmal an:
Auf der ersten Bahn befinden sich 2 Elektronen - damit ist sie voll. Insgesamt müssen aber 12 Elektronen verteilt werden. Also wird eine zweite Bahn mit 8 Elektronen besetzt. Die verbleibenden 2 Elektronen kommen auf die 3. Bahn.
Die Anzahl der Bahnen eines Atoms ist die Zeilennummer im PSE. Man nennt sie Periode. Magnesium steht in der 3. Periode (Zeilennummer links): Es hat also 3 Elektronenbahnen:


Magnesium hat 2 Außenelektronen und steht deshalb in der II. Hauptgruppe:

Die Hauptgruppennummer zeigt sofort an, wie viele Außenelektronen jedes Element hat.
Für chemische Reaktionen ist diese Zahl die allerwichtigste von allen.
Was sind chemische Reaktionen?
Chemische Reaktionen kommen zustande, weil alle Elemente vor allem nach einem streben: Stabilität. Durch chemische Reaktionen erreichen sie eine höhere Stabilität als sie vorher hatten. Eine höhere Stabilität erreicht man durch ein geringeres Energieniveau.
Eine chemische Reaktion verbindet 2 oder mehr Atome so miteinander, dass sich die Stabilität aller beteiligten Atome erhöht.
Doch was heißt "Stabilität" in der Welt der Atome? Die Antwort auf diese Frage ist so einfach! Sie erhalten Stabilität dadurch, dass die letzte Bahn voll gefüllt ist. Was das bedeutet, dazu komme ich gleich.
Zunächst einmal: Es gibt Elemente, bei denen das der Fall ist. Wir nennen sie Edelgase.
Edelgase
Sie heißen so, weil sie edel genug sind, allein durch den Raum zu schwirren. Und das tun sie: Sie fliegen als einzelne, völlig ungebundene Atome in unserer Luft überall herum. Wir atmen sie auch ein. Aber keine Sorge: Sie tun uns nichts. So, wie sie in unsere Lungen hineingelangen, atmen wir sie wieder aus. Sie sind die stabilsten Elemente, die es gibt. Jede Art der Verbindung mit anderen Elementen würde ihre Stabilität verringern. Deshalb macht es für die überhaupt keinen Sinn, chemische Reaktionen einzugehen. Sie reagieren einfach nicht, mit niemandem. Darum kann man sie in der Medizin gut gebrauchen: bei sogenannten minimalinvasiven chirurgischen Eingriffen (das sind solche OPs, bei denen nicht gleich alles aufgeschnitten wird, sondern nur kleine Löcher ins Gewebe gestanzt werden, durch die der Chirurg dann Instrumente und Kamera führt) wird mit Edelgasen das Gewebe aufgepumpt, damit der Operateur Platz hat und mit seiner Kamera alles gut sehen kann. Sie reagieren in der Zeit nicht mit irgendwelchen Stoffen in unserem Körper. Die Edelgase lassen sich auch gut anregen durch Strom und leuchten dann bunt. Ganz Las Vegas ist ein Sammelsurium verschiedener Edelgase in Leuchten und Lampen. Und jeder von uns kennt die Heliumballons, die leichter sind als Luft und deshalb den Ballon stets oben behalten. Wenn man das Helium aus den Ballons einatmet, verändert sich außerdem die Stimme auf sehr lustige Weise.
Doch was macht sie so stabil?
Auch die Antwort auf diese Frage ist leicht: eine mit 8 Elektronen besetzte Außenbahn - mit einer einzigen Ausnahme: der 1. Bahn, hier passen nur 2 Elektronen drauf. Sie ist mit 2 Elektronen voll besetzt. Das betrifft aber nur 2 Elemente - Wasserstoff (H) und Helium (He).
Alle anderen Elemente streben auf ihrer äußersten, vom Kern am weitesten entfernten Bahn eine Gesamtzahl von 8 Außenelektronen an. Dann sind sie stabil.
Diese 8 Elektronen auf der äußersten Bahn zu bekommen, ist also das Bestreben aller Elemente.
Es ist ein Naturgesetz und wir nennen es die OKTETT-REGEL. Oktett kommt vom lateinischen Wort "octo", was "acht" heißt.
Da die Elemente damit den Zustand der Edelgase anstreben, wird die Oktettregel auch als Edelgas-Konfiguration bezeichnet.
Wie erreichen andere Elemente diese Stabilität?
Auch die Antwort auf diese Frage ist leicht und beschreibt schon den ganzen Sinn hinter chemischen Reaktionen:
Sie nehmen die fehlenden Außenelektronen von anderen Atomen. Das andere Atom gibt seine Außenelektronen hingegen ab. Manchmal teilen sie sich aber auch fehlende Elektronen und benutzen sie gemeinsam.
Machen wir dazu ein Beispiel:
Natrium steht in der 1. Hauptgruppe und hat demnach 1 Außenelektron. Chlor steht in der 7. Hauptgruppe und hat demnach 7 Außenelektronen. Wenn beide zueinander kommen, gibt Natrium das 1 Elektron ganz außen an Chlor ab. Chlor hat nun 8 Außenelektronen und ist stabil.
Aber auch Natrium ist stabil, denn es hat nun auf seiner äußersten Bahn (das ist nun die zweite Bahn, die dritte hat sich bei der Abgabe der Elektronen aufgelöst) auch 8 Elektronen. Die Verbindung aus beiden ist ein neuer Stoff. Er heißt Natriumchlorid. Schauen wir uns das auf der Atomebene an:
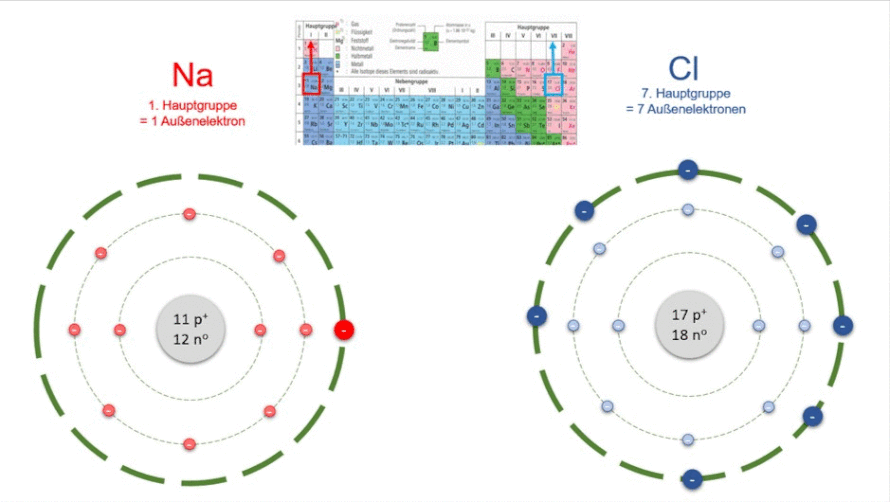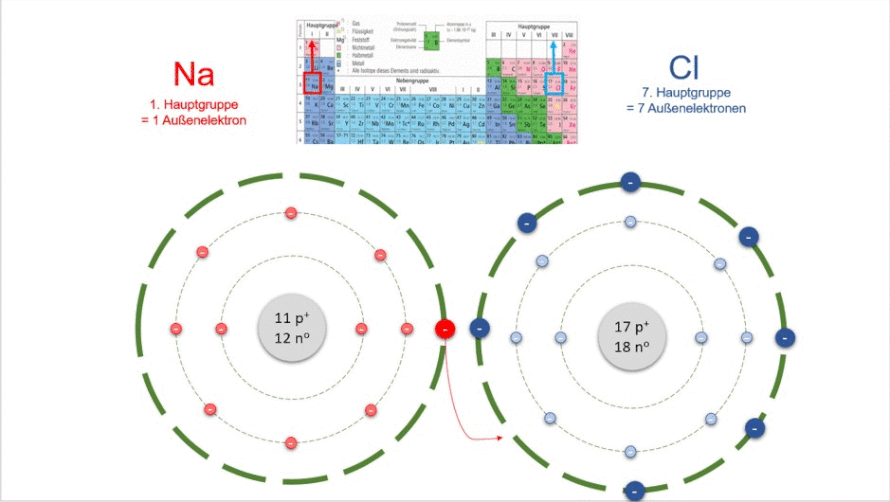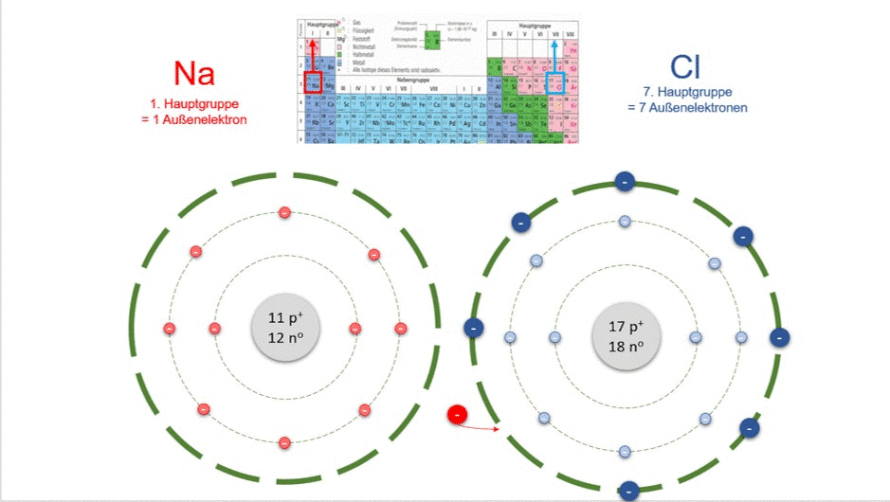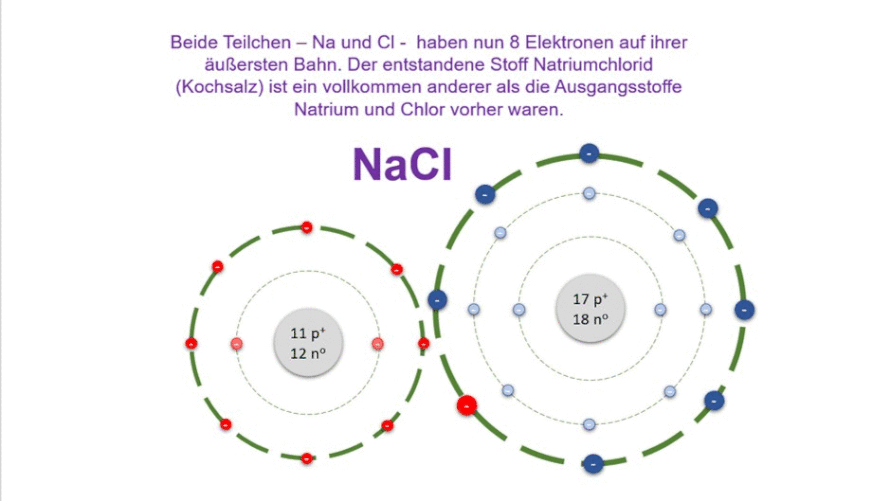
Das sind die Dinge, die im Inneren passieren. Von außen betrachtet sehen wir was anderes.
Dazu müssen wir uns die Stoffe mal ansehen, mit denen wir hier gerade unser Gedankenexperiment gemacht haben.
Natrium
Natrium ist ein weiches Metall. Man kann es mit dem Buttermesser schneiden.
Es geht explosive Reaktionen mit Wasser ein und oxidiert sehr schnell an der Luft. Das tut es, weil es sein eines Außenelektron unbedingt abgeben will - an welchen Partner auch immer: Wasser, Sauerstoff in der Luft oder vorbeiwaberndes Chlorgas. Hier habe ich ein kleines Experiment von Natrium mit Wasser für dich als Video. Was der Mann in der Hand hält, ist ein ziemlich großes Stück Natrium...

Chlor
Reines Chlor ist ein Gas und ist sehr, sehr giftig. Es kann einen Menschen innerhalb kürzester Zeit töten, wenn man es einatmet. Es raubt den meisten Stoffen seine Außenelektronen - auch denen in deinem Körper. Das macht es so extrem gefährlich.
Natriumchlorid
Natriumchlorid kennen wir alle - es ist der chemische Name für unser Kochsalz. Es ist nicht mehr giftig wie Chlorgas, ist nicht explosiv wie Natrium und weder ein Metall noch ein Gas. Kochsalz ist ein Kristall, ungiftig und wir können es essen.
Aber nicht zuviel davon, sonst entzieht es dem Körper Wasser!
Das ist Chemie: Ich nehme 2 oder mehr Stoffe, lasse sie reagieren und schon habe ich einen neuen Stoff, mit ganz anderen Eigenschaften. Und im Grunde ist alles, was im Inneren passiert, der Wechsel von Außenelektronen! Das finde ich faszinierend. Und ÜBERHAUPT nicht schwer! Oder?
Aber woher "wissen" die Stoffe, wohin die Elektronen wechseln?
Auch die Antwort auf diese Frage ist sehr leicht. Man hat herausgefunden, dass die Bindung der Außenelektronen an ihr Atom bei manchen Elementen schwach, bei manchen sehr stark und bei manchen mittelmäßig ist. Wer seine Außenelektronen nicht so fest hält, verliert sie leicht. Und wer Elektronen generell sehr stark an sich bindet, zieht auch fremde Elektronen zu sich und sichert damit seine Stabilität.
Es gibt in manchen PSE eine Zahl, die dir verrät, wie stark ein Atom seine Außenelektronen festhält: die Elektronegativität.
Je höher sie ist, desto fester bindet das Atom seine (und fremde) Außenelektronen an sich.
Das Element mit der geringsten Elektronegativität von allen ist Franzium. Die Elektronegativitätszahl von Franzium ist 0,7. Es findet sich ganz links unten im PSE (I. Hauptgruppe, 7.Periode). Franzium gibt seine Elektronen an jeden ab, der sie haben will.
Das Element mit der höchsten Elektronegativität von allen ist Fluor. Die Elektronegativitätszahl von Fluor ist 4,0. Es findet sich ganz rechts oben im PSE (VII. Hauptgruppe, 2.Periode). Reines Fluor klaut die Elektronen von nahezu jedem Partner, der sich ihm nähert.
Die Edelgase haben keine Elektronegativität, weil sie weder Elektronen abgeben noch aufnehmen.
Ein Element ist uns besonders wichtig in der Chemie, da es unseren Körper aufbaut: Kohlenstoff. Mit 2,5 liegt seine Elektronegativität ziemlich mittig. Je nach Partner nimmt es also Elektronen auf oder gibt sie ab. Da es in der 4. Hauptgruppe steht, hat es 4 Außenelektronen. Es muss also 4 Elektronen aufnehmen, um die Oktettregel zu erfüllen, oder 4 Elektronen abgeben. In jedem Fall ist es also vierwertig. Kohlenstoff und seine Eigenschaften, Vorkommen und Verwendungen findest du im nächsten Kapitel.




Kommentar schreiben
Cigdem (Donnerstag, 04 Oktober 2018 13:46)
Find ich toll
As. (Sonntag, 25 November 2018 17:39)
Super