Kohlenstoff
Reiner Kohlenstoff: Vorkommen in der Natur
Kohlenstoff ist ein faszinierender Stoff, der in verschiedenen Formen als reiner Stoff oder gebunden an andere Elemente vorkommen kann.
Seine reine Form kann Graphit, Diamant oder Kohle sein - das ist allein abhängig von der inneren Struktur, also wie die Kohlenstoffatome in seinem Inneren angeordnet sind.
Hier siehst Du ein kleines Video der SimpleChemics-Jungs zum Kohlenstoff.

Graphit
Kohlenstoff als Graphit (Bild Mitte) ist weich, leitet elektrischen Strom (allerdings schlechter als Metalle das können) und ist uns vor allem als schreibender Teil im Bleistift bekannt (Bild links). In seinem Inneren ist Graphit schichtförmig aufgebaut (Bild rechts).
An der inneren Struktur kann man erkennen, dass die Schichten des Graphits nur locker übereinander liegen. Sie lassen sich leicht gegeneinander verschieben - daher kann man mit Graphit Schichten auf Papier bringen. Wir kennen diesen Vorgang als Schreiben.
Diamant
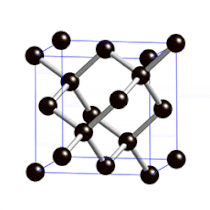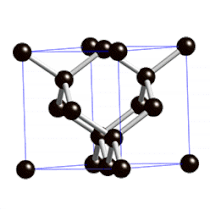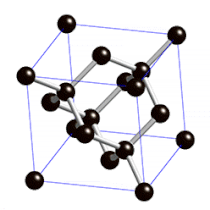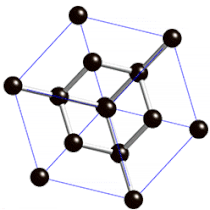
Diamanten sind die härtesten natürlich vorkommenden Stoffe der Welt.
Sie sind so hart, weil die Atome in ihrem Inneren fest in eine sehr regelmäßige Gitterstruktur eingebaut sind.
Links: Rohdiamant
Mitte: geschliffener Diamant (Brillant)
Rechts: Gitterstruktur im Inneren
Um Kohlenstoff in Diamantform zu pressen, müssen hohe Drücke über einen langen Zeitraum wirken. Das kommt in der Natur relativ selten vor, deshalb sind Diamanten so selten und sehr wertvoll.
Man kann sie auch künstlich herstellen ("Synthetischer Diamant"). Aber auch hier ist viel Energie für die Herstellung nötig, denn mann muss die natürlichen Bedingungen nachahmen und Kohlenstoff mit hohem Druck (60.000 bar - der normale Luftdruck liegt bei etwa 1 bar!) und hoher Temperatur (1200°C) pressen. Durch diesen extremen Energieaufwand sind auch synthetische Diamanten sehr teuer.
Fullerene
Sie sind faszinierende Erscheinungsformen des Kohlenstoffs, die derzeit eine Menge Wirbel verursachen, da sie tolle Eigenschaften haben, die wir gut gebrauchen können.
In natürlicher Form findet man Fullerene in Gesteinen, Meteoriten und Kerzenruß. Darin sind aber so wenige Moleküle vorhanden, dass man sie wirtschaftlich nicht nutzen kann. Man kann sie aber inzwischen synthetisch herstellen.
Links: "Buckminster-Fulleren" oder kurz "Buckyball". Es besteht aus exakt 60 C-Atomen, die in sehr regelmäßigen 5- und 6-eckigen Waben angeordnet sind. Innen bilden sie einen Hohlraum.
Sie sind gerade mal 1nm (das ist ein Millionstel eines Millimeters) groß.
Rechts: Nanoröhren. Sie bestehen aus regelmäßigen 6-Ecken aus C-Atomen und sind zylinderförmig. Sie bilden ebenfalls einen Hohlraum, sind leichter als Stahl und viel härter - was in der Automobil-, Flugzeugindustrie und der Architektur völlig neue Möglichkeiten eröffnet, die aktuell erforscht werden.
Kohle
Kohle entstand vor Millionen von Jahren aus abgestorbenem, konserviertem Holz. Genau genommen handelt es sich hier nicht um reinen Kohlenstoff, wie beim Graphit, dem Diamant oder den Fullerenen, sondern um Verbindungen, in denen Kohlenstoff den Löwenanteil ausmacht. Man sieht das hier an der inneren Struktur - da sind neben all den wabenartigen Kohlenstoff-Wasserstoff-Verbindungen auch Sauerstoff (O) und Schwefel (S) zu sehen.

Die Entstehung der Kohle ist in diesem 3-Minuten-Video sehr gut erklärt.

Sie wird seit dem Mittelalter in Deutschland abgebaut - z.B. im Ruhrgebiet.
Ihre wichtigsten, unsere Energie liefernden Zustände sind:
Alle Kohlenstoff-Erscheinungsformen (natürlich und synthetisch) im Überblick:

Kannst Du sie alle zuordnen?
Kohlenstoff in Verbindungen
Kohlenstoff ist in der Lage, mit sich selbst und vielen anderen Elementen nicht nur Verbindungen einzugehen (das können andere Elemente auch), sondern vor allem, lange Ketten zu bilden (das können andere Elemente eben nicht).
Es sind mehrere Millionen Verbindungen bekannt, die alle auf Kohlenstoff basieren, bei denen C in Kette als Grundgerüst also den Hauptanteil ausmacht. Alle anderen Elemente des Periodensystems bringen es zusammen auf gerade mal 100 000 Verbindungen. Das ist ein Zehntel dessen, was Kohlenstoff im Alleingang und mit nur wenigen anderen Elementen zusammen schafft.
Seine Verbindung mit Sauerstoff nach einer Verbrennung allein kann schon 2 Zustände annehmen: Kohlenmonoxid (CO) oder Kohlendioxid (CO2).
Vor allem aber ist Kohlenstoff eben aufgrund seiner Fähigkeit, große Moleküle zu bilden und so zusammen mit den Elementen H, N, O, P und S verschiedene Schlüssel und Schlösser für das bereits aus der Biologie bekannte Schlüssel-Schloss-Prinzip zu formen, der Grundbaustoff allen Lebens.
Die Elemente des Lebens kann man sich in Form des Wortes CHNOPS gut merken.
Die "Lebenschemie" wird als organische Chemie bezeichnet und soll uns in den nachfolgenden Kapiteln beschäftigen.
Rätsel Dich fit!
Quiz zum Kohlenstoff - Überprüfe mit Spaß Dein Wissen.


![Graphit | Rob Lavinsky, iRocks.com – CC-BY-SA-3.0 [CC BY-SA 3.0 (https://creativecommons.org/licenses/by-sa/3.0)], via Wikimedia Commons](https://image.jimcdn.com/app/cms/image/transf/dimension=210x210:mode=crop:format=jpg/path/s82008d5c8b60d082/image/i8f672c71f978deb3/version/1520914942/image.jpg)
![Graphitgitter | By Anton [GFDL (http://www.gnu.org/copyleft/fdl.html) or CC-BY-SA-3.0 (http://creativecommons.org/licenses/by-sa/3.0/)], via Wikimedia Commons](https://image.jimcdn.com/app/cms/image/transf/dimension=210x210:mode=crop:format=png/path/s82008d5c8b60d082/image/i34c31ff333230251/version/1520914942/image.png)


![Buckyball | By Sponk [CC BY-SA 3.0 (https://creativecommons.org/licenses/by-sa/3.0) or CC BY-SA 3.0 (https://creativecommons.org/licenses/by-sa/3.0)], via Wikimedia Commons](https://image.jimcdn.com/app/cms/image/transf/none/path/s82008d5c8b60d082/image/i9ae1d524ffbd0b2b/version/1520915056/image.gif)
![Nanoröhre | By Jynto [CC0], via Wikimedia Commons](https://image.jimcdn.com/app/cms/image/transf/dimension=1024x2048:format=png/path/s82008d5c8b60d082/image/id487fe84dfd5d4a0/version/1520915078/image.png)



Kommentar schreiben