Bitte unterstütze mich mit einer Spende!

Lass Deine Facharbeit, Bachelorarbeit, Masterarbeit oder Dissertation
Alle Vorgaben werden hier sauber eingearbeitet.
Kohlenwasserstoffe: Alkane, Alkene und Alkine
Wenn man die vielen Stoffe im Erdöl untersucht, stellt man einige Gemeinsamkeiten fest. Zunächst einmal bestehen fast alle Moleküle, die man darin finden kann, aus Kohlenstoff und Wasserstoff. Und diese kann man in verschiedene Gruppen unterteilen: Alkane, Alkene, Alkine und cyclische (=kreisförmig geschlossene) Verbindungen.
Natürlich möchte ich Dir auch hier nicht die wirklich guten Videos der SimpleChemics vorenthalten - bitteschön.
Aber Vorsicht! Die Jungs sind schnell. Klick hin und wieder mal auf den Stop- und Zurück-Button, dann geht das besser.

Alkane
Alkane sind Kohlenwasserstoffe mit Einfachbindungen zwischen den C-Atomen. Diese Einfachbindung wird in der Chemie mit der Endung -an gekennzeichnet. Das kleinste Molekül dieser Verbindungen ist das bereits bekannte Methan.
Homologe Reihe der Alkane
Eine homologe Reihe ist nichts anderes als eine gleichförmige Reihe. Man bezeichnet in der Chemie damit strukturell sehr ähnliche Moleküle.
Man erhält das nächste Alkan-Molekül in der Reihe, wenn man ein weiteres -CH2-Molekül einfügt:
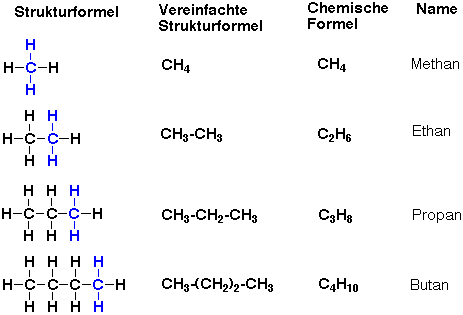
Die Reihe wird dann immer so weiter geführt. Die Ketten der Alkane werden immer länger und länger. Auswendig wissen musst Du die Alkane, die 1 bis 10 C-Atome beinhalten!
Anzahl C-Atome
1 C-Atom
2 C-Atome
3 C-Atome
4 C-Atome
5 C-Atome
6 C-Atome
7 C-Atome
8 C-Atome
9 C-Atome
10 C-Atome
Bezeichnung des C-Körpers
C
C2
C3
C4
C5
C6
C7
C8
C9
C10
Name des Alkans
Methan
Ethan
Propan
Butan
Pentan
Hexan
Heptan
Oktan
Nonan
Dekan
Formeln: Schreibweisen

Wie man in der Abbildung erkennen kann, gibt es verschiedene Möglichkeiten, Formeln zu schreiben. Sie sind alle korrekt. Welche man nutzt, hängt davon ab:
- wofür man eine Formel benutzt
- was verlangt wird.
Die Strukturformel zeigt an, wie die Atome im Molekül angeordnet sind. Auch sie ist nicht ganz voillständig, da sie in 2D dargestellt wird. Moleküle sind aber dreidimensional, also 3D.
Eine vereinfachte Strukturformel fasst die C-Atome mit ihren H-Atomen zusammen. Bei der stark vereinfachten Strukturformel werden alle identischen Gruppen zusammengefasst.
Und bei der Summenformel sieht man keine Struktur mehr, man sieht nur noch die Anzahl und Art der Atome im Molekül.
Eigenschaften und Vorkommen der Alkane
Alkane sind reaktionsträge, da die C-Atome mit den H-Atomen sehr stabile Bindungen eingehen - warum sollten sie sich umorientieren, wenn ihr Ziel (Stabilität) bereits erreicht ist?
Sie sind hydrophob (= nicht mit Wasser mischbar), lösen sich aber sehr gut in sogenannten organischen Lösungsmitteln, wie Fetten und Ölen (= lipophil).
Außerdem sind sie gut und unter Abgabe hoher Energie brennbar. Deshalb verwenden wir sie sehr gern als Brennstoffe und Treibstoffe, die man in Erdöl und Erdgas findet:
-
Methan bis Butan:
Die kurzen Ketten sind gasförmig und werden zum Erzeugen von Wärme (heizen, kochen usw.) benutzt. -
Pentan bis Oktan:
Die längeren Ketten sind sehr dünnflüssig und können daher in normalen Benzinmotoren verbrannt werden. Sie ergeben zusammen das, was wir als Benzin kennen. -
Nonan bis Hexadekan (Alkan mit 16 C-Atomen):
Die noch längeren Ketten sind für den Einsatz in Benzinmotoren zu viskos (=zähflüssig). Für die Verbrennung in Dieselmotoren sind sie jedoch wunderbar geeignet. -
Heptadekan bis 35 C-Atome:
Diese langkettigen Alkane-Moleküle werden immer dickflüssiger und eignen sich sehr gut als Heiz- und Schmieröl für Maschinen. Die festen Paraffine werden als Kerzenwachs verwendet und dienen als Bestandteil vieler Lebensmittel und Kosmetikprodukte. -
Mehr als 35 C-Atome:
Sie belegen als Asphalt unsere Strassen. Allerdings gibt es davon im Erdöl zu viel und zu wenig von den kürzerkettigen Alkanen, die wir als Treibstoff verwenden können. Sie werden in einem Vorgang, den man Cracken nennt, in kürzere Ketten gespalten.
Hier siehst Du das Ganze als Video bei den Jungs von TheSimpleChemics.

Alkene und Alkine
Alkene und Alkine sind sogenannte ungesättigte Kohlenwasserstoffe mit mindestens einer Doppel- oder Dreifachbindung zwischen zwei C-Atomen.
Ungesättigt - wass'n das schon wieder?
Nun, die haben weniger H-Atome an ihren C's als die Alkane, sie sind also nicht mit H-Atomen "satt".
MERKE: Alle Doppel- und Dreifachbindungen nennt man ungesättigt, alle Einfachbindungen gesättigt.
Die Doppelbindung wird in der Chemie mit der Endung -en, die Dreifachbindung mit der Endung -in gekennzeichnet.
Das kleinste Molekül dieser Verbindungen ist das Ethen bzw. Ethin.
Warum eigentlich? Warum gibt es kein Methen oder Methin?
Homologe Reihen der Alkene und Alkine
Alkene

Alkine
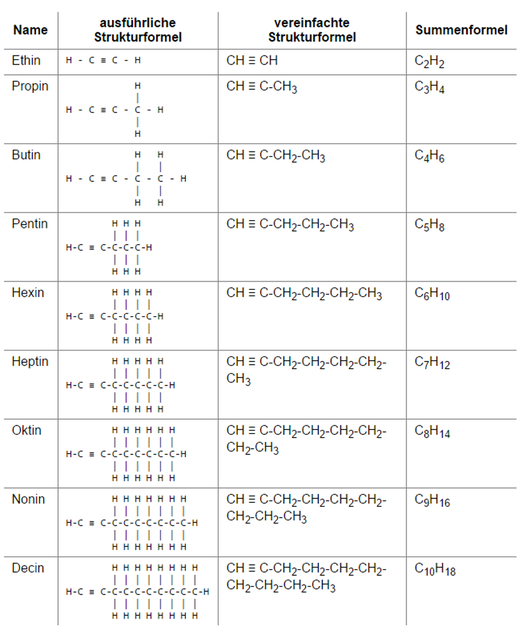
Der Wortstamm in dieser Benennung der Alkene und Alkine folgt wieder der Anzahl der C-Atome wie bei den Alkanen. Da sich derartige Reihen auch später in den Alkoholen, Alkansäuren und anderen Verbindungen finden, wiederhole ich an dieser Stelle eindringlich: LERN SIE AUSWENDIG!
Eigenschaften und Verwendung der ungesättigten Kohlenwasserstoffe
Im Gegensatz zu den Alkanen sind die ungesättigten Kohlenwasserstoffe (Alkene und Alkine) reaktionsfreudig, denn eine Mehrfachbindung ist weniger stabil als die Einfachbindung.
Da die Mehrfachbindungen leicht aufgespalten werden können, werden dabei Bindungsstellen frei, an denen sich weitere Moleküle anlagern können. So kann man aus kurzen Ketten von Alkenen oder Alkinen rasch sehr lange, zusammenhängende Ketten machen. Das ist die Grundlage der gesamten Kunststoff-Chemie.
Wie die Alkane auch verbrennen Alkene und Alkine gut und mischen sich nicht mit Wasser.
Ethin (auch Acetylen genannt) und Propin verbrennen sehr heiß (ca. 3000°C) und werden daher als Schweißgas verwendet.
In der Natur sind sie seltener zu finden als die Alkane. Die Alkine sind dabei noch seltener als die Alkene. Alkine kommen zum Beispiel im Gift der Pfeilgiftfrösche vor.
Chemische Eigenschaften der Alkane
Hier gibt es Einiges zu berichten, das allgemeine Bedeutung nicht nur für die Alkane, sondern in der ganzen Chemie hat. Wenn man sich die Viskosität (= wie dünn- oder dickflüssig ein Stoff ist) der Alkane ansieht, merkt man erstaunt, dass sie mit immer größerer Kettenlänge auch immer zähflüssiger werden. Woran liegt das?
Daran ist eine Kraft schuld, die man Van-der-Waals-Kraft nennt. Sie ist eine Anziehungskraft zwischen Materieteilchen. Eine solche Anziehungskraft kennst Du schon - jeder kennt sie: die Gravitation (=Erdanziehungskraft), die dafür sorgt, dass Du nicht in der Luft schwebst, sondern auf dem Boden läufst. Sie sorgt auch dafür, dass Planeten um die Sonne kreisen und nicht aufgrund ihres Drehschwungs einfach in den Weltraum abhauen. Eine solche Anziehungskraft ist auch die Van-der-Waals-Kraft - nur eben im Kleinen, bei den Molekülen. An sich ist diese Kraft sehr schwach, wirkt aber einfach immer: Jedes Materieteilchen hat eine solche Kraft auf andere Materieteilchen. Stell sie Dir als kleine Bindfäden vor, die man schnell zerreißen kann.
Zwischen kleinen Molekülen, wie dem Methan, Ethan, Propan oder Butan sind nur wenige Bindfäden (Van-der-Waals-Kräfte) zu finden. Man kann sie schnell zerreißen, etwas mehr Temperatur als -200°C und schwupps sind sie kaputt.
Das liegt an der Eigenbewegung der Teilchen, die sich mit höherer Temperatur immer doller bewegen. Diese Teilchenbewegung heißt Brownsche Molekularbewegung. Sie steigt mit höherer Temperatur immer mehr an und ist verantwortlich unter anderem für die Aggregatzustände der Stoffe.
Die Aggregatzustände heißen fest, flüssig und gasförmig.
Hier siehst Du ein Video dazu:

Jetzt stell Dir vor, Du hältst etwas an einem dünnen Bindfaden und es fängt an, sich schneller und schneller zu bewegen. Was wird irgendwann passieren? Klar: Der Bindfaden reißt und das Zappelteilchen schwirrt ab. Deshalb fliegen die Moleküle dieser Stoffe (Methan bis Butan) im Raum herum - jedes für sich allein und ziemlich weit entfernt voneinander.
Werden die Ketten jetzt länger (Pentan und größer), werden auch die Van-der-Waals-Kräfte zwischen ihnen mehr. Es braucht höhere Temperaturen (mehr Teilchen-Zappelei), um sie zu zerreißen. Wir nutzen das mit den Bindfäden auch: Je mehr ich eine kaputte Hose vernähe, desto mehr Bindfäden benutze ich dafür und es hält besser, auch wenn ich mich dann mehr damit bewege. Übersetzt in Chemie heißt das:
Je länger die Ketten sind, desto größer sind die Van-der-Waals-Kräfte und desto besser überwinden sie die entgegen wirkenden Kräfte der Brownschen Molekularbewegung.
Deshalb ziehen sich die längeren Moleküle stärker an als die kürzeren. Sie rücken dadurch näher zusammen und werden ab Pentan flüssig und dann immer dickflüssiger, bis sie ab ungefähr C17 so nah beieinander sind, dass sie bei Raumtemperatur fest sind. Erhitzt man sie, zappeln die Teilchen im Inneren stärker und sie verflüssigen sich und zappeln weiter, bis sie irgendwann gasförmig sind.
Es gibt eine Temperatur, bei der kein einziges Teilchen mehr herumzappelt, bei der die Brownsche Molekularbewegung also Null ist.
Man nennt diese Temperatur den Absoluten Nullpunkt und der liegt bei genau minus 273,15°C.
Nomenklatur der Alkane
Nomenklatur bedeutet nichts anderes als Namensgebung. Es gibt nicht nur einfache, lineare Alkan-Ketten, sondern auch verzweigte oder cyclische (heißt geschlossene) Verbindungen.
Verzweigte Alkane
Jede Verzweigung ändert die Eigenschaften eines Moleküls. Rein physikalisch (es wird sperriger und kann sich z.B. mit Nachbarmolekülen "verhakeln") und auch chemisch (Siede- und Schmelzpunkte ändern sich, die Löslichkeit in verschiedenen Stoffen kann sich ändern usw.). Deshalb muss jeder Chemiker auf der Welt wissen, mit welcher Verbindung genau er es zu tun hat.
Damit alle die Stoffe gleich benennen, gibt es eine Kommission. Sie legen die Regeln fest.
Sie heißen IUPAC (International Union of Pure and Applied Chemistry).
Wenn wir also solche Verbindungen benennen, tun wir das nach IUPAC. So wird es offiziell genannt. Eine Prüfungsaufgabe kann also sein: Benennen Sie diese Verbindung nach IUPAC!
Wie muss man die Alkane nach IUPAC benennen?
- Eine Verbindung wird nach der längsten Kohlenstoffkette im Molekül benannt. Dieser Name steht wie ein Familienname am Schluss.
Achtung: Die kann auch um die Ecke gehen. Solange ich sie durch Drehung um die Bindung zwischen zwei C-Atomen in eine Linie bekommen kann, ist eine Kette zusammenhängend.
- Die C-Atome der Hauptkette werden so durchnummeriert, dass die Verzweigungen kleine Zahlen erhalten.
Bei vielen Verzweigungen muss die Gesamtsumme aller Verzweigungen so klein wie möglich sein.
- Die Position jeder Verzweigung wird durch die Nummer angegeben, an der sie "hängt". Außerdem erhalten alle Verzweigungen, die aus Kohlenwasserstoffen bestehen, die Endung -yl. Alle
Verzweigungen kommen vor den "Familiennamen", also den Namen der Hauptkette.
- Wenn gleiche Gruppen mehrfach an einer Hauptkette hängen, wird ihre Anzahl durch Vorsilben, wie Di, Tri, Tetra, angegeben.
2x=Di, 3x=Tri, 4x=Tetra, 5x=Penta, 6x=Hexa usw.
- Sind mehrere unterschiedliche Gruppen mit der Hauptkette verknüpft, werden sie in alphabetischer Reihenfolge angeführt.
Aber jetzt folgen Beispiele. Beginnen wir mit nur einer Gruppe.

Die längste Kette ist hier Heptan. Am 2. C-Atom der Kette hängt eine Gruppe mit einem C, also eine Meth-Gruppe. Da sie eine Verzweigung der Hauptkette ist, erhält sie die Endung -yl: Methyl.
Zusammengesetzt erhält man:
2-Methyl-Heptan
Es ist vollkommen egal, in welche Richtung man das Molekül gedanklich dreht. Alle 4 Darstellungsweisen zeigen ein- und dasselbe Molekül. Vergiss nie: Ein Molekül kann sich meist frei im Raum drehen. In unseren Darstellungen sollten wir das beachten - soweit das an der Tafel oder auf dem Schreibblatt eben möglich ist. Ob ich an einer Kette von links nach rechts, von rechts nach links, von oben nach unten oder von unten nach oben zähle, ist vollkommen egal - solange ich eine Zählweise auch für mehrere Gruppen beibehalte und die kleinsten Zahlen wähle!
Ok, hängen wir mal 2 gleiche Gruppen an und schauen, was im Namen passiert:

Hier sind jetzt 2 Methyl-Gruppen zu sehen. Man bezeichnet sie allgemein übrigens auch als ALKYL-Gruppen, also ein ALKan, das an einer Hauptkette hängt.
Die Hauptkette ist immer noch Heptan. Eine Veränderung ist aber, dass jeweils eine Methylgruppe am 3. und eine am 4. C-Atom hängt. Diese Zahlen kommen ganz nach vorn. Die Methylgruppen sind 2x vorhanden, deshalb bekommen sie die Vorsilbe "Di", was 2x bedeutet:
3,4-Dimethyl-Heptan
Und bei 3 gleichen Gruppen?

Auch hier bekommt jede Gruppe ihre Nummer. Da es 3 gleiche Gruppen sind, erhalten sie jetzt die Vorsilbe "Tri" für 3x.
Der Name dieser Verbindung nach IUPAC lautet:
3,4,4-Trimethyl-Heptan.
Ok, und wenn die Gruppen unterschiedlich sind?

Jetzt haben wir eine Ethyl-Gruppe (eine Verzweigung mit 2 aneinander hängenden C-Atomen außerhalb der Hauptkette) und zwei Methylgruppen.
Diese Gruppen werden jetzt alphabetisch sortiert:
3-Ethyl-4,4-Dimethyl-Heptan.
Prinzip verstanden?
Hier hast du ein paar Übungen, probier Dich aus!
MERKE: Eine Hauptkette kann auch um die Ecke gehen. Moleküle, gerade lange, liegen nicht immer ganz schnurgerade im Raum. Im Gegenteil, sie können Knicke haben. Solange du gedanklich alles in eine Linie drehen kannst, handelt es sich um die Hauptkette. Ein Beispiel:

Diese Moleküle sind identisch, auch wenn das rechte einen Knick hat. Es handelt sich um ein einfaches Heptan.
Übungen zur Nomenklatur der Alkane nach IUPAC
Übung A: Benenne die Alkane nach IUPAC!
Übung B: Zeichne die Alkane nach ihrem IUPAC-Namen!
- 2,2,4,4-Tetramethyl-Pentan
- 3-Ethyl-2-Methyl-Heptan
- 2,3-Diethyl-3,5-Dimethyl-5-Propyl-Nonan
Fertig? Die Lösungen gibt es hier.
Mehr Übungen findest du sicher auch allein im Netz!
Rätsel Dich fit
Hier gibt es ein Quiz zu den Kohlenwasserstoffen, mit dem Du Dich auf Test und Prüfungen vorbereiten kannst.
Und dieses Quiz ist ausnahmsweise mal nicht von mir :-)



