Fossile Brennstoffe: Chemie des Erdöls
In diesem Kapitel befassen wir uns mit den Verbindungen aus Kohlenstoff und Wasserstoff. Diese Verbindungen sind vor allem in den fossilen Brennstoffen Erdgas und Erdöl zu finden.
Mit Untertiteln: Hier kannst Du Dir einen Film zur Entstehung und Verwendung von Erdöl ansehen (ist der oberste auf der Seite).
Erdgas
Entstehung
Text aus www.erdgas.info:
"Die Geschichte der Entstehung von Erdgas beginnt vor etwa dreieinhalb Milliarden Jahren. Der Großteil der Erde ist mit Wasser bedeckt. Winzige Mikroorganismen, Plankton genannt, die sich am Grunde flacher Meere ablagern, werden mit der Zeit durch Sand und Geröll bedeckt (Sedimentation). Ohne weitere Versorgung mit Sauerstoff, unter großem Druck und bei hohen Temperaturen werden die organischen Bestandteile in gasförmige Kohlenstoffe umgewandelt. Methan, also ERDGAS entsteht. Dieses wandert nach seiner Entstehung durch das poröse Gestein langsam nach oben, bis es auf eine undurchdringliche Schicht trifft. Hier sammelt sich das ERDGAS in Lagerstätten."
Woher kommt unser Erdgas?
Wesentliche Lieferanten von Erdgas sind für uns Russland (40%), Niederlande (30%) und Norwegen (20%). Eine kleine Menge fördern wir selbst (7%) und den Rest unseres Bedarfs bekommen wir aus mehreren Staaten.
Methan als Hauptbestandteil
![Methanmolekül-Modell | By Bin im Garten (Own work) [CC BY-SA 3.0 (https://creativecommons.org/licenses/by-sa/3.0)], via Wikimedia Commons](https://image.jimcdn.com/app/cms/image/transf/dimension=266x1024:format=jpg/path/s82008d5c8b60d082/image/ie512fbbc7f817cd1/version/1520911052/image.jpg)
Hauptbestandteil des Erdgases ist Methan (ca. 80-99% je nach Herkunft).
Methan ist eine Verbindung aus einem C-Atom (schwarz) mit 4 H-Atomen (weiß), wie im Bild zu sehen.
Im Bild ist die Struktur als Modell zu sehen.
Seine Summenformel ist CH4.
Die Förderung von Methan ist nicht ganz ungefährlich, da Methan zusammen mit Sauerstoff eine explosive Mischung, die im Bergbau bekannten "Schlagwetter", bildet.
- Dazu eine Frage.
- Finde doch mal heraus, warum die Bergleute früher einen Kanarienvorgel mit unter Tage genommen haben... Solche Dinge sind immer gut zu wissen, z.B. für ein Quizspiel ;-)
Methan kann aber auch produziert werden. Dafür benötigt man methanproduzierende Bakterien und die findet man z.B. in den Mägen von Kühen, auf Reisfeldern und in Sumpfgebieten.
Erdöl
Erdöl ist ein Gemisch aus sehr vielen unterschiedlichen Kohlenwasserstoffen, die man anhand ihrer Struktur chemisch unterteilen kann. Dazu findest Du mehr im Kapitel Alkane, Alkene und Alkine.
Hier kümmern wir uns darum, wo Erdöl vorkommt, wie es entstanden ist und was wir damit machen.
Erdölvorkommen
Die Erdölvorkommen sind nicht gleichmäßig über die Erde verteilt. In einigen Gegenden gibt es fast gar kein Erdöl, wie zum Beispiel hier in Mitteleuropa. In anderen Regionen kommen sie dafür sehr viel vor, vor allem im Nahen Osten (Saudi-Arabien, Iran, Irak, Vereinigte Arabische Emirate - VAE), Russland und Nordamerika finden sich riesige Vorkommen an Erdöl.
Erdölentstehung: Wann und wie kam das Erdöl in die Erde?
Das "Wann" ist schnell beantwortet: vor Millionen von Jahren und der Prozess der Erdölbildung selbst dauerte ebenfalls Millionen von Jahre. Deshalb kann man die Ressource Erdöl nicht einfach selbst herstellen und damit den Bedarf decken. Wir müssen es finden und fördern, um es nutzen zu können.
Zum "Wie" gibt es hier einen Text oder Du siehst Dir dieses kleine Filmchen (leider ohne Untertitel) an.

"Planet Schule" bietet außerdem eine beschriftete Animation an.
Erdölraffinerie: Wie werden aus Erdöl Treibstoffe und andere Öle?
Erdöl ist ein Gemisch - hauptsächlich aus sehr vielen verschiedenen Alkanen. Je nach Herkunft ist die Zusammensetzung sehr verschieden.
Wir nutzen es sehr vielfältig. Die mit Abstand häufigste Verwendung ist der Treib- und Brennstoff. Wir verbrennen es, um unsere Autos und LKW's, Busse und Flugzeuge anzutreiben (Treibstoff), zu kochen, zu backen oder es in den Wohnungen und Häusern gemütlich warm zu machen (Brennstoff).
Einen kleinen Teil (je nach Land 5-10% des gesamten Erdöls) nutzen wir aber auch als Straßenbelag (Teer) oder Rohstoff für die chemische Industrie. Daraus machen wir vor allem Kunststoffe, setzen es aber auch in Kosmetika und Nahrungsmitteln ein (bißchen eklig, oder?) oder brauchen es als Rohstoff, um andere Stoffe daraus herzustellen.
Erdölfraktionierung: Die Fraktionierte Destillation
Die Alkane unterscheiden sich aufgrund der Van-der-Waals-Kräfte geringfügig in ihren Siedetemperaturen. Diesen Unterschied im Verhalten von Flüssigkeiten kann man ausnutzen. Das Verfahren dafür nennt man Destillation. Da die Unterschiede sehr gering sind und sich die einzelnen Alkane nicht wirklich als einzelne Reinstoffe voneinander trennen lassen, erhalten wir am Ende sogenannte Fraktionen (= Gemische aus Kohlenwasserstoffen mit ähnlichen Siedepunkten). Zusammengesetzt aus den beiden roten Wörtern erhält man dann den Begriff "Fraktionierte Destillation".
Und so funktioniert es (In diesem kleinen Video - 3min., keine Untertitel, aber eindrucksvolle Bilder - ist das Ganze sehr gut dargestellt.):

In einer Destillationskolonne (die sind ca. 50m hoch!) wird das Rohöl auf ca. 400°C erhitzt. Einzelne Bestandteile darin (alle mit einem Siedepunkt bis 400°) fangen an zu kochen und der Erdöldampf steigt nach oben - wie der Wasserdampf zu Hause, wenn man Wasser kocht.
In der Abbildung siehst Du einen solchen Destillationsturm:

Während der Dampf nach oben steigt, kühlt er immer mehr ab.
Wenn Dampf abkühlt, kondensieren die Bestandteile, deren Temperatur unter ihren Siedepunkt fällt. Im Destillationsturm gibt es mehrere Böden mit Löchern drin, die den Dampf durchlassen. Auf den Löchern sitzen sogenannte Glockenkolonnen (= mit Glocken überdachte Löcher).
Erreichen die Moleküle im Dampf nun einen Boden, auf dem eine Temperatur unterhalb ihres Siedepunktes herrscht, kondensieren sie und fallen als Flüssigkeit auf diesen Boden. Auf einem Boden herrscht eine Temperatur, bei der mehrere Kohlenwasserstoff-Sorten gleichzeitig kondensieren - die Fraktionen. Dort werden sie gesammelt und diese Fraktionen dann in große Fässer abgeleitet.
Man kann sie unterscheiden in die Gase, die ganz oben herausströmen und extra aufgefangen werden, Leichtbenzine auf dem Boden darunter, darunter die Mittelfraktion, aus der Kerosin und Petroleum, Diesel werden, noch darunter Heiz- und Motorenöle und ganz unten der nicht kochende Rest, das Bitumen - das sind die ganz langkettigen Alkane, die z.B. als Asphalt auf der Strasse landen.
Das Bitumen enthält Kohlenwasserstoffe, die bis 400°C gar nicht kochen, also auch nicht als Dampf aufsteigen. Sie bleiben übrig und machen knapp die Hälfte des Rohöls aus.
Im Video siehst du noch einmal kurz den ganzen Verarbeitungsweg von Erdöl:

Was passiert mit dem Rest?
Das Bitumen ist viel zu viel - so viel Asphalt brauchen wir nicht. Wir brauchen aber viele Treibstoffe für den ganzen Transport mit Autos, LKW's, Schiffen und Flugzeugen.
Wir könnten jetzt einfach die Temperatur hochdrehen und dafür sorgen, dass auch die langen Ketten destilliert werden können. Du ahnst es schon: Wenn es so einfach wäre, würde man das machen. Es gibt einen guten Grund, warum man das nicht machen kann. Und der ist sehr einfach: Bei höheren Temperaturen würden die Kohlenwasserstoffe verbrennen, das heißt, sich mit Sauerstoff verbinden und als Kohlenmonoxid- und Kohlendioxid-Gase einfach verschwinden. Wir wollen sie aber erst in unseren Fahrzeugen verbrennen und diese Fahrzeuge so antreiben.
Cracken von Erdöl
Da im Bitumen vor allem langkettige Kohlenwasserstoffe enthalten sind, in Treibstoffen aber kürzere Ketten, müssen wir irgendwie dafür sorgen, die langen Ketten zu zerbrechen. Dieses Verfahren heißt CRACKEN (aus dem engl. to crack = zerbrechen).
In diesem kleinen Video (ca. 2min) siehst Du, was gemeint ist (leider ohne Untertitel).

Es gibt im Wesentlichen 2 Verfahren des Crackens, die ich Dir nachfolgend vorstellen will.
Thermisches Cracken
Randnotiz: Der Begriff "thermisch" hat immer irgendwas mit Wärme zu tun.
Beim Thermischen Cracken kommt das Bitumen in eine Art Schnellkochtopf: Unter hohem Druck kann die Temperatur jetzt hochgeregelt werden. Die langen Ketten im Inneren fangen an, immer mehr und mehr zu schwingen (Wieso die schwingen, fragst Du? Sieh in die Erklärungen zur Brownschen Molekularbewegung). Stell Dir einen kleinen Jungen vor, der eine einzelne Spaghetti (ungekocht) als Schwert benutzt und immer mehr damit herumfuchtelt. Was wird mit der Spaghetti wohl passieren? Genau: Sie wird zerbrechen. Unsere langen Alkanketten tun dasselbe, wenn sie nur doll genug schwingen. Das passiert bei Temperaturen um die 600-900°C.
Katalytisches Cracken
"Katalytisch" meint, dass an diesem Prozess ein Katalysator beteiligt ist, der extra dazugegeben werden muss. Katalysatoren lassen Reaktionen eher und schneller ablaufen, ohne dabei selbst an der Reaktion beteiligt zu sein.
Das sind ganz coole Dinger, die in der Technik (man kennt sie aus Autos, dort sorgen sie für eine schnelle Umwandlung des sehr giftigen Kohlenmonoxids in das weit weniger giftige Kohlendioxid, bevor die Auspuffgase das Auto verlassen) und auch im menschlichen Körper als Biokatalysatoren (wir kennen sie als Enzyme) eine superwichtige Rolle spielen.
Ihre Anwesenheit im Bitumen sorgt dafür, dass der Crackvorgang bei viel geringeren Temperaturen und viel schneller ablaufen kann. Das spart eine Menge Energie. Der Nachteil ist, dass die kleinen Katalysator-Kügelchen nun auch noch in der Bitumen-Suppe schwimmen und extra da wieder herausgeholt werden müssen.
Nach dem Cracken: Was machen wir mit den gecrackten Produkten?
Nach dem Cracken gibt es wieder eine große Menge unterschiedlichster Kohlenwasserstoffmoleküle, weil sie ja nicht alle gleichmäßig an der gleichen Stelle zerbrechen. Also wird diese Crack-Brühe wieder in einen Destillationsturm gebracht und fraktioniert. So gewinnen wir das, was wir am nötigsten brauchen: Treibstoffe (Benzin, Diesel, Kerosin).
In diesem Video (42min) wird dieses ganze Wissen zu unseren fossilen Brennstoffen zusammengefasst.

Veredlung von Benzin
Klopffestigkeit: Die Oktanzahl
Die Fraktionen aus dem Hochofen sind nun da, die Container mit Benzin gefüllt. Kann man das nun so in das Auto kippen? Naja, früher hat man das gemacht. Das ist aber nicht sinnvoll, weil die langkettigen, schnurgeraden Alkane zu unkontrollierter Selbstentzündung neigen. Das bedeutet, sie werden nicht erst durch die Zündkerze entzündet und verbrannt, sondern tun das selbst - bevor die Zündkerze zündet, weil sie kurz davor stark komprimiert (= zusammengedrückt) werden. Diese Kompression löst eine Selbstentzündung aus, eine Art von Explosion im Brennraum. Durch den Druck kann der Motor beschädigt werden und seine Lebensdauer sinkt rapide.
Du kennst sicher die Bezeichnungen an der Zapfsäule. Es gibt da z.B. "Super 95" oder "Super 98". Die Zahl hinten gibt die sogenannte Oktanzahl an. Je höher die ist, desto mehr verzweigte, klopffeste Kohlenwasserstoffe gibt es darin.
Oktanzahl 0 = überhaupt nicht klopffest
Oktanzahl 100 = vollständig klopffest
Der Begriff "Oktanzahl" leitet sich vom Oktan ab, mit dem das geprüft wird. Es ist ein unverzweigtes, schnurgerades Molekül, das - wie seine anderen, unverzweigten Kollegen, den Motor schädigen kann.
Man hat herausgefunden, dass verzweigte Alkane klopffest sind. Wir müssen unsere geraden, unverzweigten, den Motor schädigenden Alkane also irgendwie verzweigen, um die Langlebigkeit der Motoren zu sichern.
Klären wir zunächst die Begriffe "verzweigt" und "unverzweigt".
Verzweigte und unverzweigte Kohlenwasserstoffe
Verzweigungen können sich bilden, wenn man die Atome anders anordnet. Mit den kleinen geht das nicht, sie haben zu wenige C-Atome, um eine andere Anordnung zu finden. Ab Butan reicht die Zahl aber aus. Butan kann eine Verzweigung haben und trotzdem noch Butan bleiben - es sind immer noch nur 4 C-Atome und auch die Bindungsart (Eínfachbindung) ändert sich dadurch nicht:
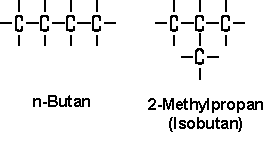
Um es besser zu sehen, sind die H-Atome nicht beschriftet. Sie sind aber da, man muss sie sich dazu denken.
Links ist das Butan (das "n" steht für "normal"), wie wir es kennen.
Rechts ragt nun aus einer kleinen C-Kette ein Ärmchen raus (die Kette ist nun ein Propan - sind ja nur 3 C's, wird auch Isobutan genannt, weil es sich vom Butan ableitet). Das ist die Verzweigung.
Zähl die C- und H-Atome. Wie viele sind es jeweils? Richtig: Die Anzahl an C- und H-Atomen ist in beiden gleich, ihre Anordnung zueinander - ihre Struktur - aber nicht.
Solche Moleküle mit gleicher Anzahl an gleichartigen Atomen, aber unterschiedlicher Struktur nennt man ISOMERE. Je länger die Kette wird, desto mehr Isomere können die Stoffe bilden:
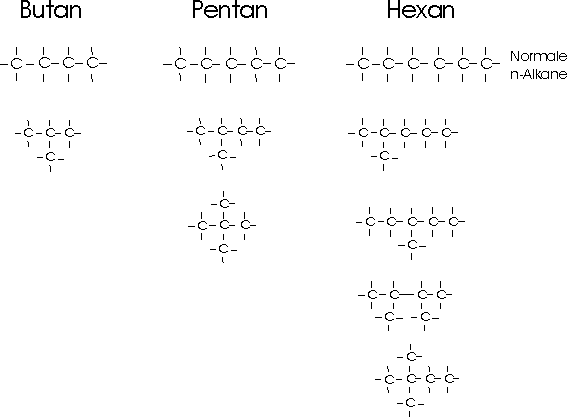
Geht man die homologe Reihe der Alkane weiter, werden das immer mehr mögliche Isomere. Decan zum Beispiel hat schon mehr als 70 Isomere.
Reformieren: Klopffestigkeit erhöhen
Nachdem wir nun also wissen, was Isomere sind, kommen wir zurück zum Problem des Motorklopfens. Jetzt ist es einfach: Verzweigte Alkane neigen eben nicht dazu, bei Kompression spontan zu entzünden. Sie sind klopffest.
Deshalb veredelt man die aus dem Erdöl gewonnenen Benzine durch ein Verfahren, das Reformieren heißt. Wie das funktioniert, müssen wir gar nicht wissen. Danach kannst Du Dich im Netz informieren, wenn es Dich doch interessiert.
Beim Reformieren werden aus unverzweigten Kohlenwasserstoffen verzweigte gemacht.
Rätsel Dich schlau!
Hier findest Du das Quiz zu den fossilen Brennstoffen, mit dem Du Dich auf die Prüfung vorbereiten kannst.
Und hier ist die Onlineversion eines Kreuzworträtsels zum Thema.

Kommentar schreiben
Max (Donnerstag, 29 April 2021 17:18)
Vielen, vielen Dank für die tollen Informationen! <3
vera (Montag, 10 Januar 2022 13:55)
super seite klasse !!! (:
187 (Donnerstag, 05 Januar 2023 12:14)
im chemie unterricht gemacht und nicht verstanden
1818 (Donnerstag, 12 Januar 2023 12:13)
Im Unterricht verdonnert bekommen und nicht verstanden