Ester, Fette und Seifen
Diese Unterrichtseinheit ist stets begleitet von einem "Ok, ich würde schon gern selbst Seife machen. Aber wie geht das?" Also habe ich das im Blog aufgeschrieben. Da kannst du nachlesen.
Lass uns jetzt die Lerneinheit "Ester, Fette, Seifen" für die Prüfung wiederholen....
Meine Tochter hat Euch eine Präsentation zum Thema Ester, Fette und Seifen erstellt.
Hier ist nun der erste Teil: Ester. Wie werden sie gebildet und woran erkennt man sie?
Ester
Eigentlich sind Fette Ester. Wieso also mache ich hier eine eigene Überschrift dafür auf? Ganz einfach: Weil es noch mehr Ester in der Natur gibt als nur Fette.
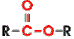
Das ist die funktionelle Gruppe der Ester. So sehen sie in der Mitte alle aus. Die "R" links und rechts stehen für "Rest" - da kann alles mögliche dran hängen.
Ester sind überall dort zu finden, wo etwas aromatisch riecht, z.B. in Blumen oder im Obst. Ester riechen kräftig, häufig als sehr fruchtige Aromen. So kann man z.B. die stinkige Buttersäure durch Veresterung mit Ethanol in einen Birnenduft umwandeln. Mit dem giftigen Methanol ergibt eben diese Stinke-Buttersäure den Geruch nach frischen Ananas. Es versteht sich von selbst, dass nach einer chemischen Reaktion die Ausgangsstoffe nicht mehr dieselben sind! Chemische Reaktionen können giftige Stoffe in harmlose umwandeln. Und umgekehrt.
Dit is Chemie und darum lieb ich das so. Ist doch toll, oder?
In den meisten Früchten sind es jedoch ganz viele Ester, die den charakteristischen Geruch ergeben. So sind in Erdbeeren wahrscheinlich um die 300 Substanzen (viele davon sind Ester) für den tollen Erdbeergeruch verantwortlich. Jede einzelne davon riecht gar nicht nach Erdbeere. Erst alle zusammen ergeben das Aroma in den Früchten. Das ist gar nicht so einfach nachzukochen. Die Chemiker bemühen sich aber fleißig.
Fette
Was Fette sind, wo sie vorkommen, welche und wie viel man davon essen sollte und wie ein Fettmolekül aussieht, hatten wir schon mal in Bio (unter Ernährung).

So sieht das als Modell aus. An einem Glycerin-Rücken hängen 3 Fettsäuren. Die Fettsäuren können gleich oder verschieden sein. In Tieren werden gesättigte Fettsäuren (nur mit Einfachbindung zwischen den C-Atomen) und in Pflanzen und Fischen meist ungesättigte Fettsäuren (mit einer oder mehr Doppelbindungen) produziert. Fette mit gesättigten Fettsäuren sind meist fest, solche mit ungesättigten Fettsäuren meist flüssig - die nennen wir dann Öle.
Soweit eine kurze Wiederholung. Nun ist Glycerin chemisch betrachtet ein dreiwertiger Alkohol (hat 3 OH-Gruppen) und die Fettsäuren sind Carbonsäuren (Kettenlänge meist 12 bis 22 C-Atome).
Ein Ester entsteht nun, wenn man einen Alkohol mit einer Carbonsäure verbindet. Machen wir das an einem einfachen Beispiel: Ethanol mit Propansäure.
Sieht auf den ersten Blick total wüst aus, oder? Sieh es Dir noch ein zweites, drittes, viertes und einige weitere Male an. Du wirst schon dahinterkommen, wie es funktioniert.
Das war die Reaktion eines einfachen, einwertigen Alkohols mit einer einfachen Alkansäure. Doch was hat das mit Fetten zu tun?

Ein Fettmolekül besteht, wie schon gesagt, aus einem dreiwertigen Alkohol. Hier liefert jede OH-Gruppe die Möglichkeit, jeweils eine Fettsäure anzubinden. Und so macht die Natur das auch. Dann haben wir dort 3 Esterbindungen (der Einfachheit halber sind die Fettsäuren nur als Summenformeln dargestellt):
Fette sind Ester aus Glycerin und Fettsäuren.
Ein Wort zum Alltag sei mir hier gestattet. Wenn Du mal auf Verüpackungen Deiner Lebensmittel nachsiehst (vor allem bei Eis, Backwaren oder Fertigprodukten), siehst Du häufig die Bezeichnung "Mono- und Diglyceride...". Das sind keine üblicherweise natürlich vorkommenden Fette, sondern Billigfette der Industrie. Die solltest Du möglichst nicht essen, weil sie Deinem Körper schaden können.
Seifen
Bei der Verseifung (so heißt der chemische Prozess des Seife-Machens) werden die Fett-Ester aufgespalten. Das heißt, Glycerin wird von den Fettsäuren getrennt und stattdessen ein Metall-Ion damit verbunden. Meist ist das Natrium oder Kalium, da für die Herstellung Natriumhydroxid (NaOH) oder Kaliumhydroxid (KOH) verwendet werden. Diese beiden Laugen liefern dann jeweils das Natrium- oder Kalium-Ion.
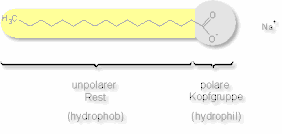
Jetzt haben wir also ein Molekül mit einer langen Kohlenwasserstoff-Kette, einer Säuregruppe und ein H der Säuregruppe ist weg, stattdessen ist ein geladenes Na+ (oder K-Ion) dabei.
NaOH mit Fetten oder Ölen ergibt feste Seifen, KOH ergibt Schmierseife (aber nicht Flüssigseife, das sind andere Stoffe aus der Gruppe der Tenside, die kommen weiter unten auf dieser Seite).
Das Molekül hat nun einen hydrophopben (oder unpolaren) und einen hydrophilen (oder polaren) Teil. Damit kann es sich wie eine Klammer sowohl mit fetthaltigen als auch mit wäßrigen Stoffen verbinden.
Doch warum ist das nötig? Die Antwort auf diese Frage gibt das Wasser selbst:

Hast Du schon einmal ein Wasserglas bis obenhin gefüllt und noch ein Stück weiter?
Es bildet sich ein Berg.
Das liegt an der starken Anziehungskraft, die geladene Wasserteilchen aufeinander haben, die Wasserstoffbrücken. Sie halten sich fest und lassen sich bis zu einem gewissen Grad gegenseitig nicht los. Deshalb türmt sich das Wasser auch da, wo eigentlich kein Glas mehr ist.
Das nennt man die Oberflächenspannung von Wasser. Sie ist wie eine Haut, die das Wasser zusammenhält. Deshalb nennt man das manchmal auch "Wasserhaut".

Man sieht sie auch in Wassertropfen - sie kugeln sich zusammen, weil die Wassermoleküle sich so stark anziehen.
![Einige Wasserläufer zusammen auf Wasser | By Fritz Geller-Grimm (Own work) [CC BY-SA 2.5 (https://creativecommons.org/licenses/by-sa/2.5) or CC BY 2.5 (http://creativecommons.org/licenses/by/2.5)], via Wikimedia Common](https://image.jimcdn.com/app/cms/image/transf/dimension=400x1024:format=jpg/path/s82008d5c8b60d082/image/i3cb31de51d5e465d/version/1520395949/image.jpg)
Oder bei manchen Insekten, die übers Wasser laufen können - der Wasserläufer hat davon seinen Namen erhalten.
Die Wassermoleküle halten sich hier so fest, dass dieses leichte Insekt oder auch leichte Blätter nicht hinabsinken können.
All diese Beispiele kennen wir aus dem Alltag. Der Grund ist immer derselbe: die große Oberflächenspannung des Wassers. Sie entsteht durch den Dipol-Charakter der Wassermoleküle. Diese elektrischen Plus- und Minus-Kräfte ziehen sich stark an und halten die Wassermoleküle zusammen.
Das hat den großen Nachteil, dass Wasser allein auch auf unserer verschmutzten Haut den Schmutz nicht abwäscht, denn das Wasser kugelt sich zusammen und rollt einfach herunter, ohne in die Rillen der Haut hinein zu gelangen. Wir haben auch Fett auf der Haut - den Talg, den wir selbst produzieren. Das verstärkt den Effekt noch, weil Fett unpolar ist und die Wassermoleküle abstößt. Der Schmutz in den feinen Rillen der Haut wird deshalb vom Wasser gar nicht berührt.
Wir brauchen also einen Stoff, der diese Oberflächenspannung aufbricht, damit unsere Haut wieder sauber wird. Fett allein kann das nicht, denn es ist nicht polar und will mit dem Wasser nichts zu tun haben. Die elektrische Ladung aber, die ein Seifenmolekül an seinem Ende hat, beeinflusst das Wasser.
Die polaren Köpfchen der Seifenmoleküle schieben sich zwischen die Wassermoleküle und stören ihre Bindung. Wenn man einen Tropfen Seife auf einen Wasserberg gibt, bricht er auf.
Besonders gut ist das hier zu sehen (mit UT):

Die Oberflächenspannung des Wassers ist nun weg und die kleinen Wassermoleküle gelangen jetzt auch an die Rillen der Haut.

Die Kügelchen aus Seifenmolekülen, die man auch Mizellen nennt, bilden eine Kapsel um die Schmutzteilchen. Mizellen ragen mit ihrem hydrophoben Ende in die Schmutzteilchen hinein und mit ihren negativ geladenen, hydrophilen Köpfchen zum Wasser -wie hier im Bild zu sehen. Das Schmutzteilchen ist im Inneren versteckt.
Die Seifenmoleküle halten damit das Schmutzteilchen in Schwebe, weg aus den Rillen der Haut.
Mit dem nächsten Wasserstrahl können sie dann weggespült werden.
Sieh Dir dieses Video (ca. 30 min) an. Es ist sehr interessant und erzählt Dir etwas über Seifen früher und heute.

Seifen gibt es schon sehr, sehr lange - 500 Jahre länger als unsere Zeitrechnung dauert. Die Sumerer, ein Völkchen im südlichen Irak, das zwischen den Flüssen Euphrat und Tigris gelebt hat, haben sie erfunden und aus Fett und Pottasche hergestellt. Was Pottasche ist? Das ist aufgekochte Asche aus der Verbrennung von Holz. Die filtriert man nach dem Kochen ab und kann Fett damit versetzen. Es wird Schmierseife draus.
Aber auch Ägypter, Römer und andere Völker hatten ihre Mittel, aus Fett waschbare Substanzen herzustellen und sich selbst zu säubern.
Tenside
Tenside sind Stoffe, die die Oberflächenspannung von Wasser vermindern können.
Das älteste Tensid ist die Seife mit ihrer Fähigkeit, Wasser und Fett miteinander zu verbinden. Inzwischen gibt es auch andere Tenside, die diese Fähigkeit haben.
Unser Körper hat seine eigene Tensidfabrik: die Leber zum Beispiel. Sie stellt Galle her, ein wichtiges Tensid für die Vorbereitung der Fette im Essen zum Verdauen. Wenn Tenside in Essen oder Kosmetika angewendet werden, nennt man sie allerdings nicht Tenside, sondern Emulgatoren. Sie haben aber beide dieselbe Struktur und tun dasselbe: Sie sorgen dafür, dass Fett und Wasser sich verbinden.
Im Zuge der Industrialisierung und vor allem der Weltkriege wurden andere Tenside entwickelt. Warum? Die Leute hatten großen Hunger, da durften die Fette nicht mehr für Seife verwendet werden. Sie wurden zum Essen gebraucht.
Seife hat außerdem einige Nachteile, die ebenfalls die Suche nach anderen Mitteln zum Waschen notwendig machten:
- Seife bildet zusammen mit Kalk sogenannte Kalkseife. Die wäscht nicht und bildet gräuliche Ablagerungen in Waschbecken und Badewanne.
- In Stoffen sorgt sie für graue Ablagerungen in den Fasern, sodass die ihre Farbintensität verlieren - alles bekommt mit der Zeit einen gräulichen Schimmer.
- Seife ist sehr basisch und greift beim Waschen vor allem Naturfasern, wie Wolle oder Seide, an. Die verlieren dann ihre Struktur und Form.
Leute mit großem Erfindergeist, Wissenschaftler, haben dann andere Rohstoffe gesucht und gefunden.
Ab 1930 ungefähr ging die rasante Entwicklung los, nachdem man im 19. Jahrhunderts bereits herausgefunden hatte, wie Seife eigentlich funktioniert. Die Suche nach neuen Waschmitteln wurde auch durch die Entwicklung der Waschmaschine begünstigt, sie kam allerdings erst gegen Mitte des 20. Jahrhunderts so richtig in Schwung. Aber von da an war der Bedarf an Waschmitteln enorm!
Die neuen Tenside hatten mehrere Vorteile, wie sich schnell herausstellte:
- Man brauchte keine natürlichen Fette und Öle mehr, die für die Ernährung der Menschen sehr wichtig waren.
- Einige von ihnen konnten mit hartem Wasser viel besser umgehen als Seife.
- Einige griffen sensible Gewebe, wie Seide oder Wolle, nicht an, wie Seife das tut.
- Man konnte eine Menge mehr damit machen als nur mit Seife allein - nicht nur zum Waschen, sondern auch in Kosmetika oder Lebensmitteln sind Tenside wichtig.
Das erste Tensid kam bereits Ende des 19. Jahrhunderts auf. Es wurde aus Fett und Schwefelsäure hergestellt und hatte den Vorteil, dass es zum Wollewaschen geeignet war. Man brauchte aber auch dafür Fette, die für die Ernährung viel dringender benötigt wurden.
Das erste Tensid ohne Fett wurde 1928 aus Kohle und Schwefelsäure hergestellt.

Seine hydrophile Gruppe war nicht mehr die Säure-Gruppe aus Fettsäuren, sondern eine Schwefelsäure-Gruppe. Den hydrophoben Alkanteil lieferte die Kohle. Das Fettalkoholsulfat war entstanden. Es konnte auch in hartem, kalkhaltigen Wasser gut waschen.
Allerdings hatten diese ersten Tenside einen enormen Nachteil: Sie waren biologisch nicht abbaubar, haben also die Umwelt belastet. Vor allem mit der Verbreitung von Waschmaschinen machte sich das böse bemerkbar. Auch ich kenne noch die Zeit der verschmutzten Flüsse, mit teilweise großen Schaumbergen aus den 70er/80er Jahren. Es ist merkwürdig, wenn die Gewässer draußen nach Waschmitteln riechen. Die Klärwerke haben das Problem damals zunächst nicht lösen können.
Bis es endlich auch umweltverträglichere Tenside gab.
Heute gibt es eine Unmenge an Tensiden und Emulgatoren für verschiedenste Anwendungen. Es gibt so viele, dass man sie schon in Gruppen einteilen muss - ähnlich wie bei den Kunststoffen - um den Überblick nicht zu verlieren. Diese Gruppen solltest Du kennen:
-
Anionische Tenside
Sie tragen eine negative Gruppe an der hydrophoben Kette. Dazu gehören Seifen und das Fettalkoholsulfat.
Verwendet für: Waschmittel, Geschirr-Reiniger oder Körperwaschmittel. -
Kationische Tenside
Sie tragen eine positive Gruppe an der hydrophoben Kette. Ihre Waschwirkung ist gering. Sie lagern sich aber an an die negativ geladenen Fasern von Kleidung an und machen sie weicher.
Verwendet für: Weichspüler, Haarspülungen -
Nichtionische Tenside
Sie haben gar keine geladene Gruppe im Molekül, sondern andere Reste - wie z.B. Zucker.
Sie sind sehr wirkungsvoll in saurem und hartem Wasser, viele davon sind gut haut- und umweltverträglich.
Verwendet für: Flüssigseife, Kosmetika und Lebensmittel -
Amphotere Tenside
Sie haben eine positiv geladene UND eine negativ geladene Gruppe. Sie sind sehr gut hautverträglich.
Verwendet für: Haarshampoos, Verbesserung der Hautverträglichkeit bei Zugabe in Kosmetikprodukten
Rätsel Dich fit
Hier gibt es ein Kreuzworträtsel.
Bearbeitung: Klicke auf die Zahl, um die Frage zu sehen und die Antwort einzutippen.
Wenn Du mit dem ganzen Kreuzworträtsel fertig bist, klicke auf den kleinen blauen Button mit Häkchen unten rechts.

